Történelmi áttekintés
1901-ben Dr. Aloysius „Alois” Alzheimer és kollégája, Dr. Emil Kraepelin különös beteget vizsgálta nagy múltú frankfurti kórházban, a Städtische Anstalt für Irre und Epileptische-ben. Az 51 éves nőbeteg, Auguste Deter pár év leforgása alatt fokozatosan elveszítette rövid távú memóriáját, a vizsgálat idején képtelen volt megjegyezni tényeket, számsorokat akár néhány perc időtávlatában is. Emellett jelentős személyiségbeli és viselkedésbeli változásokat is mutatott, amelyek közül leginkább szembe tűnőek a paranoid téveszmék voltak. A beteg rendkívüli módon felkeltette az akkor 37 éves fiatal orvos figyelmét és a következő években is nyomon követte, egészen a hölgy 1906. április 8-án bekövetkezett haláláig. Ezt követően kollégáival elvégezte az agy szövettani vizsgálatát és Bielschowsky festés segítségével két furcsa patológiai jelenséget is leírt, amiloid eredetű sejteken kívül elhelyezkedő plakkokat és sejten belül jelenlévő neurofibrilláris kötegeket. 1906 őszén eredményeit bemutatta a Tübingenben rendezett nyugat-német pszichiátriai kongresszuson, majd publikálta is azokat (Alzheimer 1907). 1910-ben Kraepelin az általa szerkesztett Handbook of Psychiatry 8. kiadásában, a Presenile and Senile Dementia fejezetben a korábban leírt betegséget Alzheimer-kórnak (AK) nevezte el, amely így közismertté vált az orvostudományban. A 1990-es években többen megkérdőjelezték, hogy Alzheimer valóban a ma AK-nak ismert betegséget írta-e le, mígnem 1998-ban lehetőség nyílt az eredeti mikroszkópos minták tanulmányozására, igazolva azt, hogy az eredeti felismerés valóban helyes volt. Az 1970-es évekig nem sokat tudtunk arról, hogy az ismert neuropatológiai eltérések milyen módon magyarázhatják a látott tüneteket, mígnem Katzman megalkotta a kolinerg hipotézist, miszerint a bazális előagyi idegsejtek elhalása és az általuk előállított acetilkolin mennyiségének csökkenése állhat a kognitív hanyatlás hátterében. Ezt követte a 80-as években a felelős fehérjék tulajdonságainak alaposabb megismerése, a béta-amiloid szekvenálása, majd a tau azonosítása a neurofibrilláris kötegekben. A 90-es években jelentős áttörés történt, megtalálták a legfontosabb genetikai rizikófaktorokat, az amiloid prekurzor protein (APP), apolipoprotein-e4 (apoE4), és a presenilin 1,2 (PSEN1-2) géneket. Ebben az időszakban a társadalom figyelme is a betegség irányába fordult, amit jelez, hogy 1994. szeptember 21-én rendezték meg az első nemzetközi Alzheimer Napot. A 90-es évek végét terápiás sikerek is koronázták, bevezetésre kerültek az első beavatkozási lehetőséget kínáló gyógyszerek, az acetilkolin-észteráz gátlók. A 2000-es éveket a képalkotó és biomarker azonosítási technikák bevezetése jellemezte, ekkor sikerült a legfontosabb szerkezeti eltéréseket azonosítani és a liqour-diagnosztikai lehetőségeket kidolgozni. Habár jelenleg is kb. 80 terápiás vizsgálat zajlik , a betegség kezelésének lehetőségei rendkívül korlátozottak, ezért mind a pathomechanizmusra mind a terápiára vonatkozó kutatások története egyre több új fejezettel bővül.

Alois Alzheimer

Auguste Deter
Epidemiológia
A modern szemlélet szerint az AK-t a major neurokognitív betegségek csoportjába tartozik, amely kategória olvasztótégelye mintegy 60-100 különböző eredetű idegrendszeri betegségnek. Ezek között akár 20%-ban visszafordítható formák is előfordulnak, úgymint a pszichiátriai betegségekhez (pl. depresszió, generalizált szorongás) társuló kognitív hanyatlás, vitaminhiányos állapotok (pl. B12 vitaminhiány), metabolikus eltérések (pl. pajzsmirigy alulműködés), agyi traumák (pl. szubdurális vérömleny), toxikus ártalmak (pl. hepatikus enkefalopátia) és agyvíz keringési zavarok (pl. normál nyomású hydrocephalus). Ezek felismerése esszenciális, hiszen időben történő kezelésükkel a kognitív panaszok javíthatóak.
A betegségcsoport nagy részét azonban a progresszív, vissza nem fordítható formák alkotják, úgymint frontotemporális demencia, diffúz Lewy-testes demencia, Parkinson demencia, kortikobazális degeneráció stb., létrehozva a demencia, a National Institute on Aging által 1995-ben alkotott, de ma is érvényes definícióját: „Progresszív intellektuális hanyatlás, amely elég súlyos ahhoz, hogy a napi rutinban és szociális tevékenységben károsodást okozzon”.
Ebből a betegségcsoportból kiemelkedik az AK rendkívüli gyakorisága folytán, hiszen becslések szerint az időskori kognitív hanyatlás mintegy 55%-áért ez tehető felelőssé. Ennek fényében nem meglepő az a tény, hogy a fejlett világban az AK a 6. leggyakoribb halálhoz vezető ok, azonban a tartós egészségkárosodáshoz és alacsony életminőséghez vezető okok között messze az élen van, főként progresszív és krónikus természete miatt. További jelentős probléma, hogy míg a klasszikus népbetegségekhez kötött halálozás csökken, addig az AK-val kapcsolatos szinte exponenciális növekedést mutat. Az állapot óriási terhet jelent a betegek gondozásában résztvevő családtagok számára is. Fontos figyelembe vennünk azt a társadalmi jelenséget, hogy a gyermekvállalás korának kitolódása miatt ezen gondozók zömében az úgynevezett szendvics generáció tagjai, tehát miközben gondoskodnak idős szüleikről, nevelik saját iskoláskorú gyermekeiket is. Az Amerikai Egyesült Államok statisztikáit tekintve, ez kb. 16 millió családot érint, több mint 18 milliárd óra fizetetlen szabadsághoz vezetve évente (Alzheimer’s Assocation 2016). Mindezen faktorokat összevetve nem meglepő az a tény, hogy az egészségügyi és szociális kiadásokat tekintve az AK a világ egyik „legdrágább” betegsége, amely óriási anyagi terhet is ró a társadalomra. Például véve a fent említett országot, a becsült összkiadás 2016-ban 260 milliárd amerikai dollár volt (Alzheimer’s Assocation 2016). A hatalmas prevalencia és a jelentős társadalmi teher miatt vált az AK korunk egyik legnagyobb orvosi és társadalmi kihívásává.
Okok és rizikófaktorok
Sajnálatos módon az intenzív kutatások ellenére sem értjük pontosan, hogy milyen okok vezetnek a betegség kialakulásához. Ezek megértéséhez hasznos elkülöníteni a korai kezdetű betegséget (early onset Alzheimer’s disease: EOAD) és a késői formát (late onset Alzheimer’s disease: LOAD). Bár a két betegségforma egymással tüneti és klinikai szempontból azonos, a kiváltó okok jelentősen eltérnek. EOAD esetén a háttérben genetikai mutációt találunk, amely vagy öröklődő családi halmozódású- így familiáris AK-nak is nevezzük- vagy sporadikus megjelenésű mutáció. Ez kb. az összes AK eset 1-5 %-ban fordul elő, leggyakrabban a PSEN1, ritkábban a PSEN-2 és APP gének mutációi okozzák. LOAD esetén a probléma összetettebb, genetikai, környezeti és életmódi tényezők együttes hatásaként alakul ki a betegség, hasonlóan a daganatos betegségek megjelenése kapcsán ismert Knudson-féle kettős ütés hipotézishez. A genetikai tényezők közül legismertebb az apoE4-es allél szerepe, amely a betegség gyakoribb és korai megjelenéséhez köthető. Ezen kívül a teljes genom analízis módszerével (GWAS) további 33 potenciálisan rizikót hordozó kromoszóma régió került azonosításra. A genetika fontosságát jól mutatja az a tény is, hogy Down-szindróma esetén is jóval magasabb az AK kialakulásának esélye.
Az öregedés maga az egyik leglényegesebb tényező, mivel 65 éves kor fölött a betegség létrejöttének rizikója 5 évente megduplázódik. Ez a határ szolgál az EOAD vs. LOAD elkülönítésre is, amelynek pontosságát azonban sokan vitatják. Jelentős rizikót növelő faktorok továbbá a klasszikus szív-és érrendszeri tényezők, a magasvérnyomás betegség, 2-es típusú cukorbetegség, dohányzás, elhízottság, magas vérkoleszterin szint, magas vérzsírsav szintek, magas vér homocisztein szint (Lindsay és mtsai 2002). Érdekes és intenzív kutatások tárgyát képezi a traumás agykárosodás szerepe, amelyet főként sportolók esetében vizsgálnak. Úgy tűnik, hogy a fejet ért traumák is AK vagy Parkinson-szerű demencia kialakulásához vezetnek, amelyet összefoglalóan krónikus traumás encefalopátiának nevezünk. Maga a jelenség leírása nem új, 1928-ban Dr. Harrison Stanford Martland közölte boxolók esetében, demencia pugilistica-ként elnevezve. Az idegrendszer más jellegű érintettsége szintén rizikó tényezőként szerepelhet, amelyek közül kiemelkednek az affektív zavarok. A pszichiátriai betegségek demenciát utánzó megjelenése jól tetten érhető azok klasszikus nevezéktanában is, úgymint dementia praecox skizofrénia esetén, illetve pszeudodemencia major depresszió esetén. A pszichiátriai gyakorlatból szintén jól ismert, hogy a súlyos fokú szorongással és hangulati deprimáltsággal járó kórformák esetén a kognitív funkciók jelentős csökkenése tapasztalható. Megemlítendő, hogy szintén emeli a rizikót bizonyos gyógyszerek krónikus használata, amelyek közül kiemelendőek a benzodiazepin készítmények, antikolinerg szerek és a protonpumpa gátlók. Az életmódi tényezők szintén rendkívül fontosak, hiszen a magasabb edukáció, idegen nyelvek ismerete, többes anyanyelvűség, a fenntartott szellemi és fizikális aktivitás, továbbá a kiegyensúlyozott táplálkozás protektív tényezőknek bizonyultak. Mindezek fontosságát jól mutatja, hogy nagy betegszámú vizsgálatok foglalkoznak ezzel a problémakörrel (pl. FINGER study) és becsléseik szerint akár több millió AK esetet is megelőzhetnénk évente ezen faktorok precíz kontrolljával.
Összefoglalóan azt mondhatjuk, hogy a betegség kialakulásához számos tényező együttes fennállása szükségeltetik, amelyek megváltoztatják az agy metabolikus folyamatait: csökken az idegszövet vérellátottsága, agyi mikrovérzések jelennek meg, pericita migráció zajlik, gyulladás alakul ki, főként a mikrogliális folyamatok aktivációjával és jellegzetes gyulladás irányába ható citokinprofil átrendeződéssel, a lipidtranszporterek megválzotnak és az amiloid eltávolítását célzó mechanizmusok károsodnak. A különböző folyamatok végén azonban nagyon hasonló neuropatológiai kép jelenik meg: amiloid plakkok rakódnak le az idegsejtek között és foszforilált tau kötegek az idegsejtekben.
A két fehérje megjelenése azonban mind időben, mind térben eltérő. Az amiloid a betegség korábbi fázisában jelenik meg, elsődlegesen a mezolimbicus területeken, a hippocampus-ban és a bazális előagyban, majd fokozatosan a teljes agykérget érinti. A tau feltehetően a betegség későbbi stádiumában jelenik meg, jellegzetesen az transentorinális kérgi területeken, majd a limbikus áreákban, végül a neokortexben. A megjelenési és terjedési minta leírása Braak munkacsoportjához köthető.
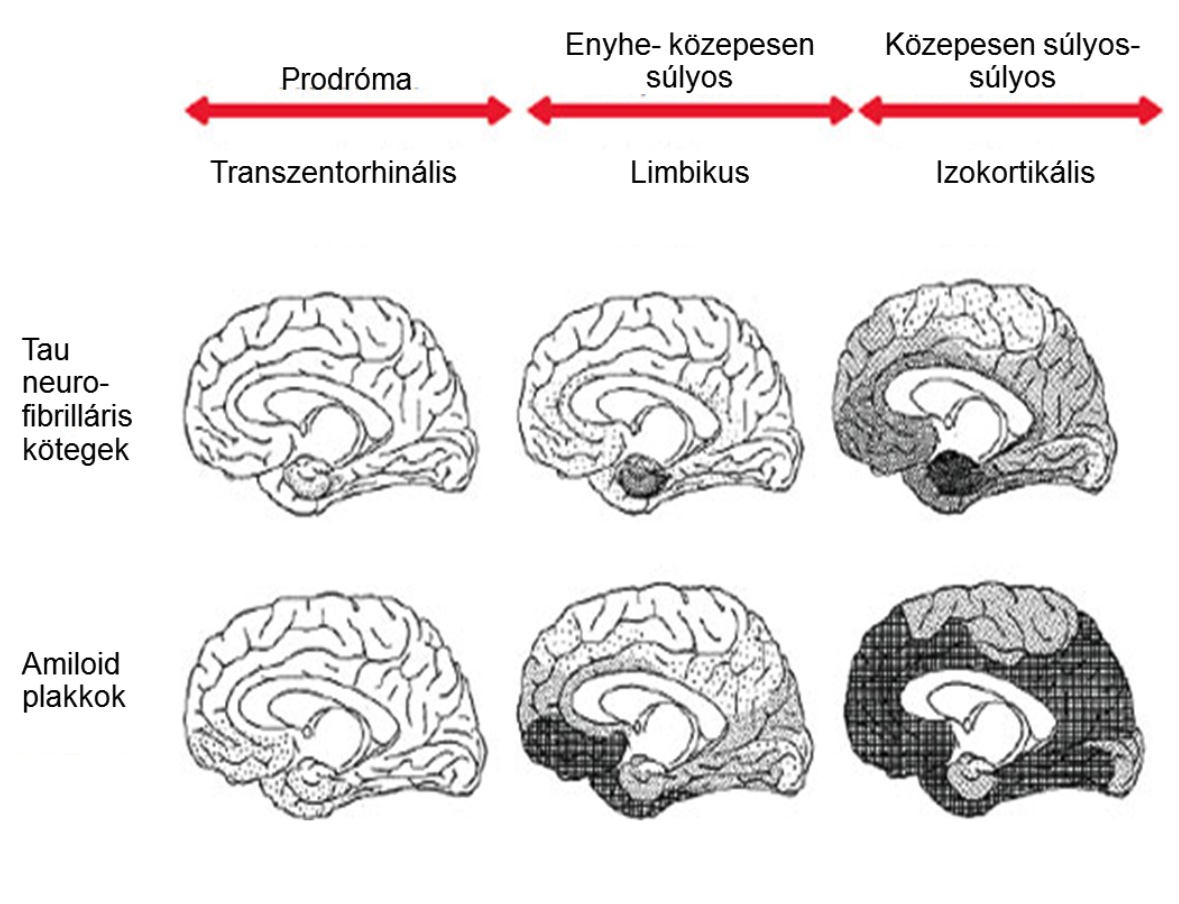
A tau és amiloid depozitumok propagációjának Braak által leírt és ábrázolt stádiumai (Braak és Braak 1991).
A terjedés során a megváltozott szerkezetű fehérjék lerakódása miatt a neuronok elhalnak, majd az sejtekből kiürülő fehérjét újabb neuronok veszik fel, így mintegy átadva a kóros mintát egymásnak. Fontos megjegyezni, hogy viszonylag friss felismerés az, hogy a fehérjék, főként az amiloid megjelenése évtizedekkel megelőzi az első tünetek jelentkezését, így bizonyos biomarkerek már ebben az időben is pozitivitást mutathatnak.
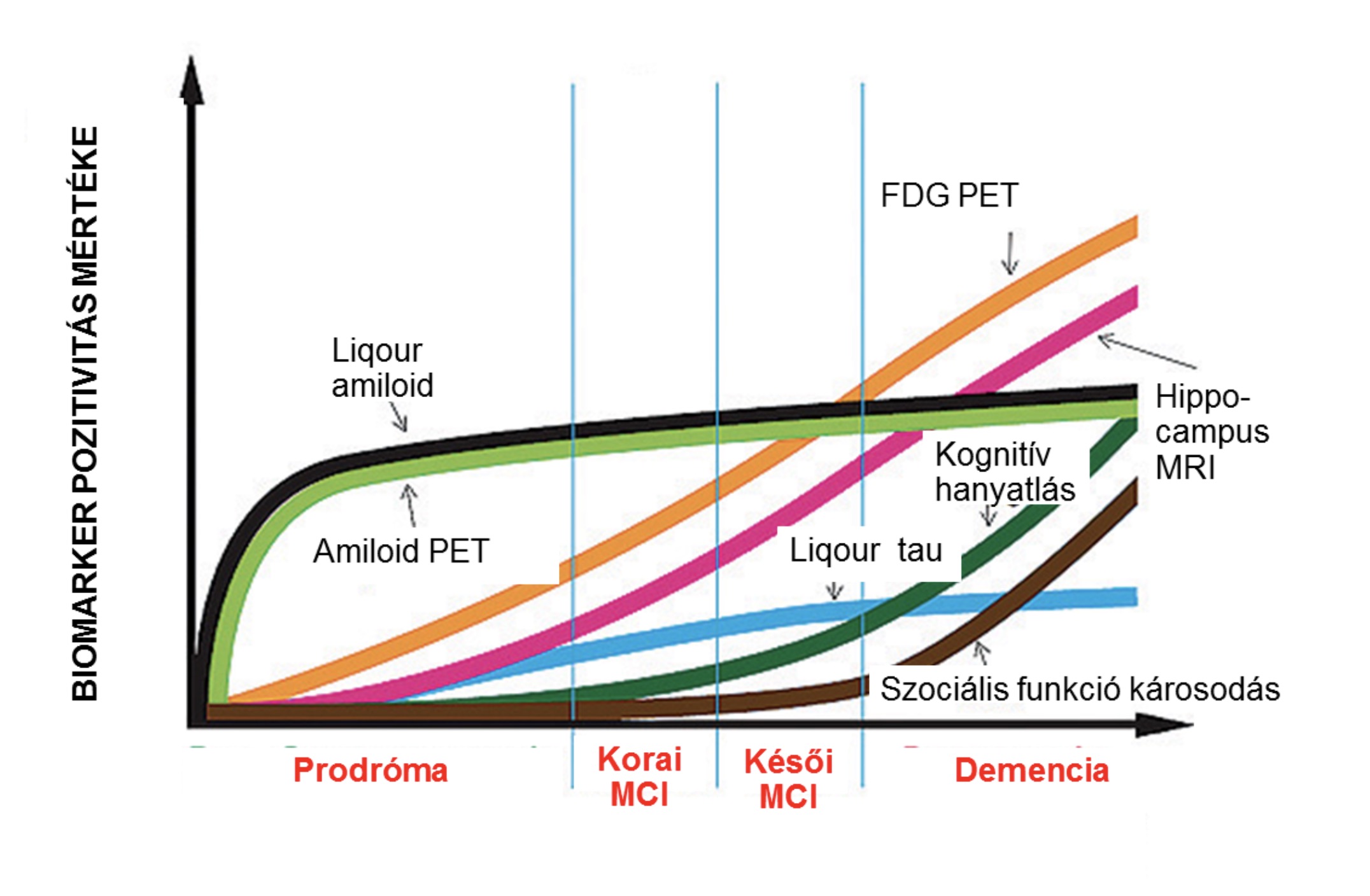
Az Alzheimer-kór fő biomarkereinek prediktív értékének változása a betegség progressziója során (Forrás: Alzheimer’s Disease Neuroimaging Initiative- http://www.adni-info.org/Scientists/ADNIOverview.html).
Érdekes módon, a kóros fehérjék megjelenése és a terjedés módja meglepően hasonlít a prion betegségeknél látott képhez, amely az AK prion hipotéziséhez vezetett. Jelenleg számos vizsgálat igazolja, hogy a patológiás protein befecskendezése az idegrendszerbe a betegség kialakulásához vezethet. Az fertőzéses eredet kérdése, továbbá a bélflóra szerepe a betegség kialakulásában továbbra is nyitott a tudományban, és intenzív viták tárgyát képezi.
Tünetek
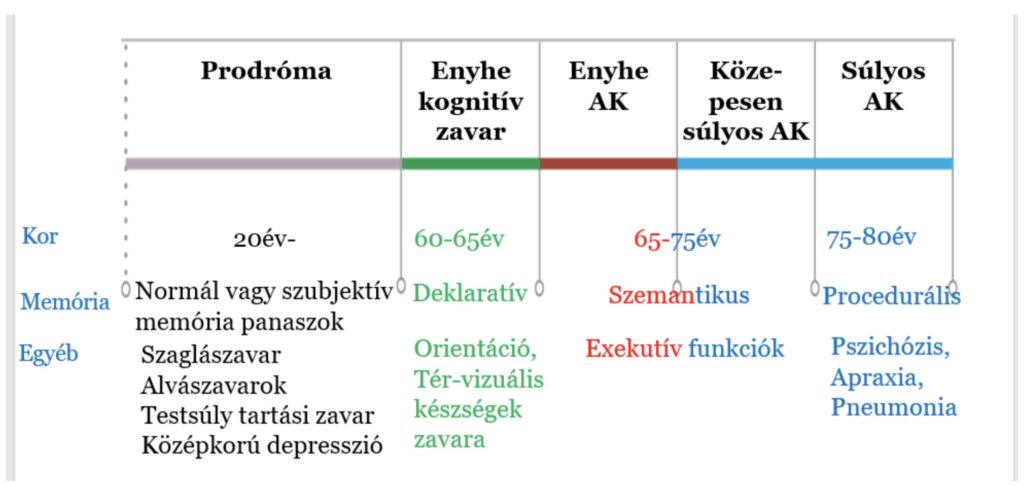
Az első tünetek jellegzetesen 65 éves kor körül kezdődnek, az ennél korábbi kezdet viszonylag ritka és jellemzően a tisztán genetikai eredetű variánsoknál fordul elő. A betegség lefolyása az első tünetek jelentkezésétől kezdve körülbelül 4-8 év, azonban jelentős változatosságot mutat,így akár 20-22 év is lehet. Fontos jelenség azonban, hogy a klinikailag egyértelmű tüneti kép megjelenése előtt, már akár évtizedekkel korábban elkezdődik a patológiai jelenségekkel összhangban a prodromális fázis, amelynek felismerésére intenzív kutatások összpontosulnak. Úgy tűnik azonban, hogy bár memória panaszok nem mutathatóak ki ekkor, az autonóm és limbikus funkciók károsodása már jelentkezhet. Ezek közül kiemelt szerepe lehet a szaglási érzékelés károsodásának (hipózmia), alvászavarok megjelenésének, a testsúly kontroll elvesztésének (a testsúly paradoxon jelensége AK esetében azt jelenti, hogy bár az túlsúly megléte rizikófaktor, a betegség kialakulása előtt a betegek veszítenek testsúlyukból, így hamisan úgy tűnhet, hogy az időskorba lépve a túlsúly protektív faktor AK szempontjából) és a középkorúaknál megjelenő depressziónak. A depresszió megítélése- miszerint a betegség prodrómája vagy rizikó faktora- nem egységes, mindazonáltal konszenzus kezd kirajzolódni arról, hogy a korai megjelenés inkább rizikó faktor, míg az időskor elején kialakuló inkább a betegség kezdetét jelzi.
A prodromális fázist egy enyhe kognitív károsodással jellemzett periódus követi, amelyet az irodalomban, mint enyhe kognitív zavar vagy mild cognitive impairment (MCI) említenek. Az MCI azt jelenti, hogy az érintett személy tapasztalja a kognitív funkciók romlását, azonban ezt kompenzálni tudja, így kognitív deficit nincs, a demencia definíció követelménye nem teljesül. Becslések szerint a 65 év feletti lakosság kb. 20% érintett. Fontos megemlíteni, hogy az MCI jelenléte ugyan magasabb rizikót jelent a demencia kialakulására nézve, de tényleges kognitív deficit nem minden esetben fejlődik ki, az MCI állapot stagnálhat vagy akár javulhat is. Ezen fázis észrevétele esszenciális, hiszen segíthet a korai beteg azonosításban és a terápiás beavatkozások időben történő bevezetésében. Az MCI klinikai diagnózisa a Petersen kritériumrendszer szerint történik.
Az Alzheimer-kór progressziója során a kognitív és neuropszichiátriai tünetek jellegzetes sorrendben követik egymást. A korai fázisában a rövid távú memória károsodása a legjellemzőbb panasz. Jellegzetesen a hippokampuszhoz köthető deklaratív epizodikus memória (tényszerű, tudatosan felidézhető pl. bevásárlólista) tartalmak a leginkább érintettek, míg a neokortikális területekhez kötött szemantikus (pl. élmények) és procedurális memória (pl. mozgásformák kivitelezése) megőrzött. Figyelemre méltó, hogy a hosszú-távú memória megkímélt. Jellegzetesen tehát az új memória tartalmak megjegyzésének (bevésésének) képessége veszik el. Ehhez gyakran társul orientációs zavar is, amely általában a térbeli tájékozódást jobban érinti (pl. eltévedés boltból hazafelé menet), mint az időbelit (pl. milyen hónapot írunk most). Jellegzetes lehet, hogy a pácienssel történő beszélgetés során felidézhető egy korábbi átmeneti amnéziás epizód (a betegnél mintha kiesett volna egy időszaka a napnak).
A középsúlyos stádiumban a szemantikus memória (pl. családtagok felismerése) is érintetté válik, továbbá típusosan a betegek elveszítik az exekutív funkciókat (pl. fizetés, ügyintézés, gyógyszerek bevétele). A homloklebenyi tünetképzés részeként a betegségbelátás képessége is csökken. Gyakran jelentkeznek viselkedésbeli változások is: apátia (súlyos hangulati nyomottság), agitáció (ingerültség), agresszív viselkedés, akár hallucinációk és pszichózis is. Ilyen módon a beteg folyamatosan elveszti önellátásra való képességét.
Súlyos stádiumban az összes kognitív funkció érintetté válik, jellegzetes a motoros funkciók károsodása is, akár súlyos mioklónusok formájában is. A beteg elveszíti öngondoskodási és tájékozódási képességét és ágyhoz kötötté válik. Súlyos AK-ban a leggyakoribb halálok a tüdőgyulladás
Diagnosztika
A betegség diagnosztikus protokollja az elmúlt évtizedek során többször változott, ezzel sajnos meg is nehezítve az aktuális klinikai vizsgálatok eredményeinek összevetését a régebbi elemzésekkel. Fontos megemlíteni, hogy bár a diagnosztikus repertoár bővült, a definitív diagnózist ma is csak a szövettani vizsgálat adhatja. A klinikai tünetek és adatok alapján kizárólag a valószínű AK diagnózis állítható fel. A diagnózishoz elsődlegesen a demencia tényének bizonyítása szükséges, amelyhez szinte elegendő a korábban ismertetett fogalom ismerete: a szociális életre hatással levő kognitív hanyatlás, amely progressziót mutat. Természetesen az egyéb pszichiátriai és fizikális ok kizárandó, amelyhez kiterjesztett laborvizsgálatok és képalkotó vizsgálatok elengedhetetlenek. Javasolt neuropszichológiai teszt elvégzése, amelynek legalább 5 kognitív funkcióra ki kell terjednie és legalább 2-nek érintettnek kell lennie: memória, komplex exekució (pl. írás, mondatalkotás), téri- és vizuális készségek, nyelvi funkciók, viselkedés és személyiségváltozások. A neuropszichológiai teszt elvégzése segíti a különböző neurokognitív betegségek azonosítását is. A leggyakrabban javasolt tesztcsomagok az Addenbrooke Kognitív Vizsgálat (AKV), Montreál Kognitív Felmérés (MoCA), Alzheimer’s Disease Assessment Scale-Cog (ADAS-Cog) és a Mini- Mentál Teszt (MMS) az ajánlott határértékek figyelembevételével. Ezek közül az MMS kevésbé szenzitív, ma inkább elsődleges szűrésre és stádium besorolásra ajánlják, mindazonáltal az egyik leginkább elterjedt demencia vizsgáló teszt, amely esetében a 25 alatti érték jól jelzi a demencia meglétét. Stádium besorolásra szintén kiválóan alkalmazható a Clinical Dementia Rating Scale (CDR) is.
A demencia meglétének megállapítása után az AK valószínűsítéséhez szükséges az elhúzódó betegségkezdet, igazolt progresszió (anamnézis alapján, lehetőség szerint ismételt neuropszichológiai vizsgálatokkal alátámasztva), a típusos tünetkezdet (amnesztikusan rövid távú epizódikus memória zavar, később szótalálási nehézség vagy téri, vizuális készség károsodás vagy exekutív diszfunkció) és az egyéb okok kizárása, amelyhez a strukturális MR vizsgálat elvégzése alapvető követelmény. Ennek elemzése során az általános agyi állománycsökkenés (atrófia) mellett a kétoldali halántéklebenyi-homloklebenyi túlsúly kérgi atrófia, valamint a hippocampus volumetriával bizonyított méretcsökkenése keresendő. Megerősíthetik a diagnózist bizonyos agyvíz biomarkerek, úgymint az alacsony Ab-42 vagy Ab-42/Ab-40 ráció, illetve az emelkedett tau és foszfo-tau (p-tau) értékek. Amennyiben elérhető, úgy pozitron emissziós tomográfiás (PET) biomarkerek pontosíthatják a diagnózist (amiloid, tau trészerek). Az ismertetett kritériumrendszert az Alzheimer-betegség NIA-AA (National Institute on Aging and Alzheimer’s Association) kritériumainak nevezzük.
A másik jelenleg használatos diagnosztikus rendszer az Amerikai Pszichiátriai Társaság (APA) által megalkotott DSM- 5 (Diagnostic and Statistical Manual of Mental Disorders V). Ez a demencia stigmazitáló fogalmát tompítandó, a demencia szó helyett a major neurokognitív betegség használatát favorizálja. A memória károsodás prioritása csökkent a diagnózisban, felismerve azt, hogy az AK sok esetben ún. nem amnesztikus formában kezdődik (pl. beszédzavar, exekutív zavar). Abban az esetben, ha a szociális függetlenség megőrzött, de deficit szintű károsodás kimutatható a kognitív funkciókban, úgy enyhe kognitív károsodásról beszélhetünk (MCI). Amennyiben a szociális aktivitás is érintett már és az érintett személy másokra szorul napi teendői ellátásában, úgy a definitív neurokognitív betegség diagnózisa megállapítható (ez lényegében a klasszikus demencia definíció). Abban az esetben, amennyiben a biomarkerek véletlen pozitivitást mutatnak és az érintett nem produkál-produkált tüneteket, úgy prodrómális AK-ról beszélünk. A DSM rendszer tehát a tünetek progressziójára helyezi a hangsúlyt, használata fontos lehet a korai biomarker azonosításra irányuló vizsgálatokban, illetve az intervenciós kísérletekben.
Alapvető kritériumok
Szupportív kritériumok
A)
Korai és jelentős epizódikus memóriakárosodás az alábbi jellemzőkkel:
Beteg vagy hozzátartozó által észlelt, jelentős, progresszív változás a memória funkciókban legalább 6 hónap időtávlatban
Objektívan, neuropszichológiai vagy klinikai vizsgálattal azonosított epizódikus memória zavar
Az epizódikus memória zavar az AK első tüneteként jelentkezett önállóan vagy egyéb panaszok kíséretében
Szupportív kritériumok
B)
Medialis temporális lebeny atrófia
Bifrontalis-bitemporalis atrófia a hippocampus, amygdala, entorhinalis kéreg volumen veszteségével koponya MRI vizuális analízisével vagy mennyiségi volumetriás méréssel.
C)
Kóros liqourbiomarker értékek
Csökkent amiloid-béta 1-42 koncentráció, emelkedett tau vagy p-tau értékek. Bármilyen más validált liquor biomarker
D)
PET biomarker pozitivitás
Csökkent glükóz metabolizmus bilaterálisan a temporo-parietális területeken. Más validált PET trészer (amiloid, tau PET)
E)
Bizonyított autoszomális domináns AK mutáció
Terápia
Jelenlegi tudásunk szerint az AK nem gyógyítható. Rendkívül fontos azonban kiemelni, hogy ez nem azonos azzal, hogy nem kezelhető, ezáltal jobb életminőséget biztosítva a betegnek és az érintett hozzátartozóknak. Az optimális kezelési lehetőségek biztosításához azonban elengedhetetlen a megfelelő diagnosztika és a betegség stádiumának azonosítása. A betegség fel nem ismerése akadályozhatja az időben elkezdett terápiát, illetve lehetetlenné teheti a jelenleg is futó gyógyszerkutatásokba való bekapcsolódást. A differenciál diagnózishoz szükséges vizsgálatok elmaradása ahhoz vezethet, hogy nem vesszük észre a háttérben megbújó kezelhető okot (pl. el nem végzett pajzsmirigy funkció vizsgálat), vagy egy másik degeneratív betegség fennállásakor nem ajánlott terápiához nyúlunk, kárt okozva ezzel a betegnek (pl. neuroleptikum alkalmazása diffúz Lewy-testesdemenciában). Ennek fényében a terápia bevezetése és változtatása előtt mindig megfontolandó, hogy az ajánlott diagnosztikus algoritmuson végighaladtunk-e.
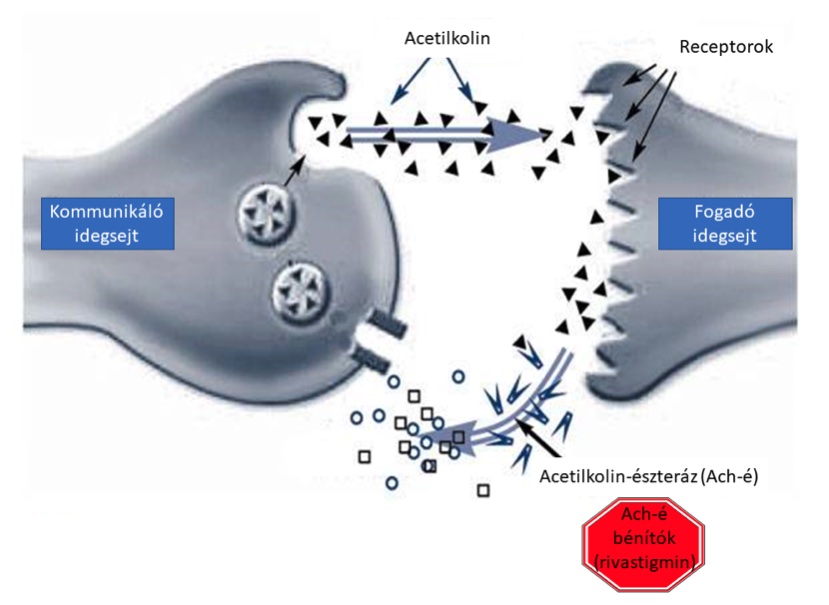
A terápia a megfelelően megválasztott gyógyszerek alkalmazása mellett, pszicho- és szocioterápiás megfontolásokat is tartalmaz. Mivel a beteg együttműködési készsége csökken, ezért a hozzátartozó alapos tájékoztatása és a kezelési lehetőségek megbeszélése rendkívül fontos. A leggyakrabban alkalmazott szerek a kolinészteráz-gátló készítmények, úgymint a donepezil, galantamin és rivastigmin. Ezek jellemzően az enyhe és középsúlyos stádiumban javasoltak. A közepes stádiumtól kiegészíthető a terápia memantinnal is, amely N-metil-D-aszpartá t(NMDA) receptor gátló. Fontos faktor a társuló pszichiátria zavarok megfelelő terápiája is, amely sokszor kifejezetten nehéz, főként az alvászavarok és az agitáltság kezelhető nehezen. A gyógyszeres terápia mellett egyre nagyobb súlyt kapnak a rehabilitációs jellegű beavatkozások is, úgymint az étrend optimalizálása, a rendszeres sportolás, beszédterápia, a motoros és kognitív tréning. A nem-gyógyszeres beavatkozások azért is különösen fontosak, mert az elmúlt 2 évtizedben több mint 100 fázis III vizsgálatot kellett sikertelenség miatt megszakítani. Többek között ennek is köszönhető, hogy a betegség gyógyításával kapcsolatos figyelem az utóbbi időben egyre jobban kiterjedt az AK-ban észlelhető egyéb társbetegségekre is.
Az elmúlt években új gyógyszerfejlesztési irányvonalak is megjelentek. Az Alzheimer-kór súlyosságát mérséklő terápiás lehetőségek egyike a β-amiloid plakk kialakulásának megelőzése. Jelenleg három molekula aggregációgátló hatását vizsgálják: tramiprostate, colostrinin, sciloinozitol. A tramiprostate az amiloid és a glükózaminoglikánok közötti kötődést gátolja, így az amiloid fehérjét monomer formában tartja. A colostrinin amiloid aggregációját gátló képességét egyelőre csak állatkísérletek bizonyítják, de az eddigi eredmények ígéretesek. A sciloinozitol hatékonyságát szintén csak egereken végzett állatkísérletek bizonyítják. Képes stabilizálni a már aggregálódott amiloidot, így megakadályozza a neuronokra kifejtett toxikus hatását.
A másik lehetőség a tau fehérje szerkezetének megváltozását akadályozó szerek kifejlesztése. A fenotiazin, metiltioninium-klorid (metilénkék) tau aggregációt gátló hatását sejtkultúrán végzett kísérletek igazolták, de már alkalmazták őket az Alzheimer-kór kezelésében is, bár jelentős eredményeket csak a metilénkék használatával értek el. Egy hat hónapig tartó kezelés sorozat alkalmával Alzheimer-kóros betegek kognitív funkciói folyamatosan javultak. A tau fehérje foszforilációját gátló szerek közül a kináz inhibitoroknak tulajdonítanak nagy jelentőséget. Potenciális jelöltnek tűnik a glikogén-szintáz-kináz-3, amelynek legtöbbet tanulmányozott gátlója a lítium. Ezen kívül más szerek is szóba jöhetnek, többek között a pirazolopiridin valamint a valproinsav hatóanyag tartalmú szerek.
A legtöbb gyógyszeripari cég által kutatott terápiás stratégia az immunterápia. Két típusa ismert: aktív (oltás) illetve a passzív (monoklonális antitestek alkalmazása) immunterápia. Az aktív immunizálás során inkább a β-amiloidaggregációját akadályozó folyamatokat vizsgálják, míg a passzív immunizálás során a tau fehérje szerkezetének megváltozását igyekszenek meggátolni. Az eddigi kutatási eredmények tekintetében egyelőre a passzív immunizálás tűnik hatékonyabb eljárásnak, de egyik terápiás lehetőség sem hanyagolható el a jövőben.
Megelőzés
A Finn Geriátriai Intervenciós Vizsgálat (FINGER-study) 2012 és 2014 között zajlott, célja a demencia megelőzésében használható korai intervenciós terápiás lehetőségek elemzése volt. A 4 pillére épülő vizsgálat 1260, 60 és 77 év közötti résztvevő bevonásával zajlott, fő elemei az alábbiak voltak: diétaváltás, a fizikális aktivitás fokozása, kognitív és szociális tréning, továbbá a kardiovaszkuláris és metabolikus rizikófaktorok kontrollja. Az étkezés alapját a hivatalos finn nutríciós ajánlások képezték, a fizikális mozgásterápiát gyógytornászok irányították, amely kiterjedt az izomerő és az állóképesség fejlesztésére, továbbá az egyensúly javítására. A WHO ajánlás szerinti 150perc/hét fizikális aktivitást alkalmazták. A kognitív tréning 10 alkalommal végzett, pszichológusok által vezetett 60-90 perces tréningből állt. Ezt követően egyénre szabva, a gyengébb kognitív doménekre specifikusan alakítottak ki számítógépes tesztcsomagot, amelyet a résztvevők hetente 3-szor 10-15 percig használtak. A rizikótényezők kontrollja az aktuális egészségügyi ajánlások fényében zajlott. A vizsgálat végeztével jelentős különbséget azonosítottak a kontroll és az intervenciós csoport között, a bevontak esetében a demencia kialakulása szignifikánsak ritkább volt.
A korszerű intervenciós vizsgálatok arra hívják fel a figyelmet, hogy a betegség és a betegség-rizikó azonosítása a lehető legkorábbi stádiumtól kívánatos, mivel a korán és célszerűen megkezdett prevenciós stratégia jelentősen csökkentheti a súlyos állapot kialakulásának esélyét. Természetesen a tünetképzés fázisában is fontos, hogy a gyógyszeres terápiát az életmódi intervenciós lépések kiegészítsék. Feltételezhetően a jövőben új gyógyszeres és prevenciós lehetőségekre derül fény. Ennek alapfeltétele, hogy az Alzheimer-kór patológiai és komorbid tényezőit alaposan megismerjük.
Az alvás szerepe
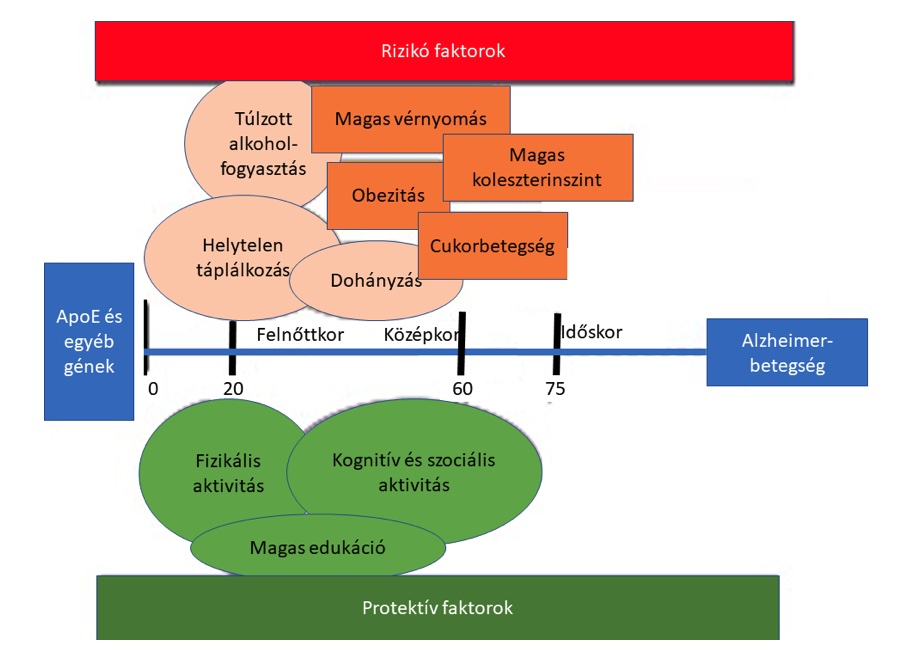
Az elmúlt évtizedek során az alvás funkciójáról alkotott elképzelésünk drasztikusan megváltozott: míg korábban, mint passzív, az erőforrások feltöltésére szolgáló folyamatot képzeltük el, manapság egyre inkább aktív, az agyi alkalmazkodó készség alappillérének számító mechanizmusnak tekintjük. A tanulásban és memória folyamatokban betöltött funkciónak azonban alapvető követelménye az alvás szerkezeti épsége. Az alvási struktúra tanulmányozásának leggyakoribb módja a poliszomnográfiás (PSG) vizsgálat, amely során az agyi- és izomaktivitást, a szemmozgásokat, a légzési tevékenységet és a szívritmust egy időben regisztráljuk. Az agyi aktivitás elemzésének használatával az alvást különböző szakaszokra tagolhatjuk: REM (rapid eye movements) fázisra, illetve non-REM (NREM) alvásra, amely három stádiumból áll (S1, S2, S3). Mindegyik stádiumnak megvannak a jellegzetes azonosító jelei, például az S2 fázisra jellemző K- komplexumok és alvási orsók. Az S3 stádium a jellegzetes hullámtevékenység miatt lassú hullámú alvásként is ismert.
Az alvásváltozások a normál öregedési folyamat jól ismert velejárói, amely során az alvás feltöredezik, az elalvási idő megnyúlik, az éjszakai felébredések száma és hosszúsága megnő, a nappali álmosságérzet fokozódik. Gyakorivá válnak az alvás-ébrenlét ciklus felborulásából adódó alvászavarok, továbbá alvásfüggő légzés és lábmozgás zavarok, például obstruktív alvási apnoe szindróma, nyugtalan láb szindróma, periódikus lábmozgás zavar szindróma. A lassú hullámú alvás mennyisége csökken, míg az S1 és S2 fázisok hossza válasz képpen megnyúlik. A REM fázis jellegzetesen megőrzött. További jellemző változás az alvási orsók és K-komplexumok számának csökkenése.
Fontos megfigyelés, hogy az alvászavarok az AK rizikótényezői is lehetnek. Insomnia esetén leírták, hogy az alvási megvonással párhuzamosan az AK patológiájára jellemző amiloid plakkok jelennek meg. Továbbá, az AK-nak az alvási problémák kétségkívül részjelenségei, amely során az öregedési folyamatra jellemző eltérések fokozottabban jelentkeznek, továbbá a REM fázis érintettsége is megfigyelhető. Feltételezhetően, ennek a szakasznak az érintettsége jelezheti a betegség progresszióját is, mivel az enyhe stádiumban normál képet mutat. Összefoglalóan elmondhatjuk, hogy az alvás tanulmányozása az AK kutatás ígéretes területe, amely segíthet abban, hogy megértsük a kognitív funkciók károsodásának hátterét.
Az emberi alvásszerkezetre jellemző EEG minták és alvási stádiumok.
Az epilepszia szerepe
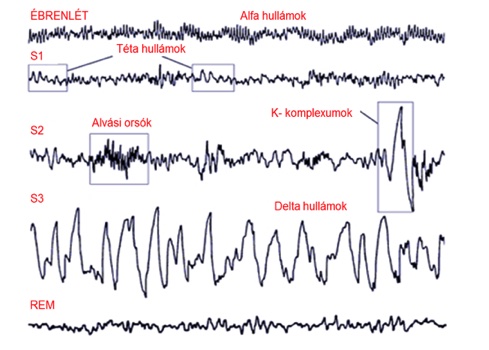
Az epilepszia a 6. leggyakoribb idegrendszeri betegség, amelyet időszakosan visszatérő epilepsziás rohamok jellemeznek. Előfordulási gyakoriságának csúcsai a gyermekkor időszaka, illetve az időskor. Az epilepsziás rohamok során az idegsejtek rendellenesen erős összehangoltsággal aktiválódnak, így nagyobb sejtcsoportok egyidejű elektromos kisülése jön létre. A roham klinikai jellegzetességeit az határozza meg, hogy az érintett idegsejt csoport az agy melyik területén helyezkedik el, és hogy onnan milyen irányba tud tovaterjedni a rendellenes aktivitás. A rohamok 60%-ban konvúlzióval (megmerevedés, majd görcsös rázkódás) járnak, azonban a maradék 40%-ban azokat nem kíséri szemmel látható mozgási tünet. A kóros aktivitás érintheti a nagyagykéreg teljes felszínét, ekkor generalizált rohamról beszélünk, vagy csak a kéreg bizonyos területeire terjed ki, ezek a fokális epilepsziás rohamok. A roham során létrejövő tüneteket az érintett kérgi terület funkciója határozza meg. A rohamok után a kérgi területek átmeneti kimerültségéből adódó tünetek jellemzőek, például Todd-parézis a mozgató kéregben zajló rohamok esetében, vagy konfúzió, pszichózis a halánték- vagy a homloklebeny tüneteként. Az epilepszia betegség azonban több annál, mint rohamok összessége. Epilepsziás működészavar hatására az érintett agyszövetben szerkezeti és molukuláris elváltozások jönnek létre. A változások folyományaként nő az epileptitogenitás és epilepsziás rohamok alakulnak ki. A rohamok között az agy tevékenysége szintén eltér a normálistól és jellegzetesen rövid ideig tartó kóros kisülések jellemzik, amelyek hatással vannak az agyi hálózati működések épségére. Ezeket összefoglalóan interiktális epileptiform jelenségeknek nevezzük. Az epilepsziával élők életminőségét elsősorban az határozza meg, hogy milyen gyakran jelentkeznek a rohamok, így a gyógyszeres törekvések fő célkitűzése a rohammentesség elérése. Az új kutatási eredmények szerint azonban az interiktális jelenségek is kifejezetten fontosak, mert az epilepsziához gyakran társuló kognitív károsodással leginkább ezek hozhatóak összefüggésbe.
Interiktális kisülések az ábra bal oldalán, míg generalizált roham EEG képe az ábra jobb oldalán.
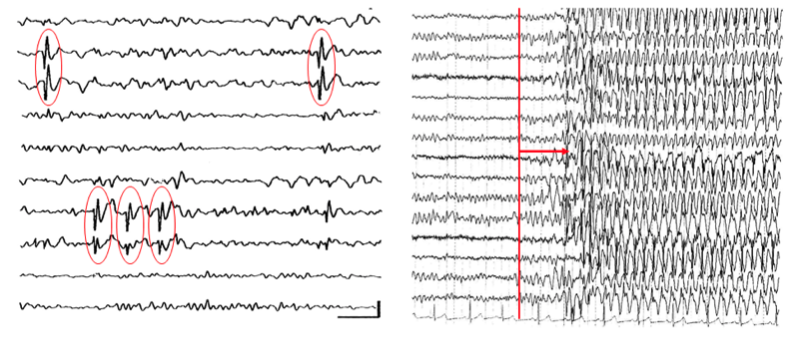
A két betegség összekapcsolása meglehetősen új kutatási terület, csak az elmúlt évtizedben került a tudományos érdeklődés középpontjába, annak ellenére, hogy korábbi vizsgálatok már találtak átfedéseket. 1892-ben Paul Blocq és George Marinesco elsőként írta le az amiloid plakkok jelenlétét emberi agyszövetben, a minta epilepsziás betegek műtéti mintáiból származott. Később az amiloid jelenléte epilepsziás betegekből származó agyszövetben megerősítést nyert, sőt egy másik fehérjét is kimutattak ezekben a mintákban, a tau-t. Egy 2016-ban megjelent patológiai közleményben, amely 33 terápiára nem reagáló epilepsziás beteg temporális lebeny rezektumaiból készült, 94%-ban azonosítottak foszforillált-tau kötegeket (Tai és mtsai 2016). További azonosságok is leírásra kerültek, pl. az AK-ra jellemző csökkent hippocampális térfogat is kimutatható volt temporális lebeny epilepsziában szenvedő betegeknél is. Funkcionális mágneses rezonancia (fMRI) vizsgálattal csökkent funkcionális kapcsoltságot és resting-state aktivitást találtak a default mode network (DMN) áreáiban mindkét betegség esetén. PET vizsgálattal a bazális halántéklebenyi területek csökkent működése ábrázolódott mindkét esetben. Ha figyelembe vesszük, hogy az AK-ban az elsődlegesen érintett agyterület a hippocampus, amely agyunk leginkább epileptogén területe–és egyben a leggyakoribb epilepszia típus, a temporális lebeny epilepszia (TLE) forrása, a hasonlóságok megléte nem meghökkentő. Jelenleg számos embereken végzett klinikai kutatás is igazolta, hogy Alzheimer-kórban az epilepsziás rohamok előfordulása gyakoribb és azok rontják a betegség túlélését és a betegek életminőségét. Ezzel párhuzamosan számos gyógyszerkutatás indult az epilepszia ellenes gyógyszerek felhasználásával kapcsolatban az AK terápiájában.
Alzheimer-kórban szenvedő és epilepsziás beteg PET felvétele. Látható nyilakkal jelölve, hogy mindkét beteg esetében jelentősen csökken a halántéklebeny anyagcseréje.
A gyulladás szerepe
A gyulladás olyan biológiai válasz, amely során egy lehetséges sejtkárosító tényező megjelenésére védelmező, őrködő mechanizmusok aktiválódnak. A hirtelen fellépő, heveny gyulladásos reakció lényege, hogy a kóros elemet minél előbb eltávolítsa, a szervezet egészséges állapotát visszaállítsa. Amennyiben a gyulladásos választ serkentő tényezők továbbra is megvannak vagy az azt szabályzó folyamatok zavart szenvednek, úgy krónikus gyulladás alakul ki. A krónikus reakció során a szövetek károsodnak, a szervezet saját sejtjeit is támadó sejtek képződhetnek: ennek az autoimmun folyamatnak számos betegség kialakulásában szerepe van. Az Alzheimer-kór inflammációs feltételezését Krstic és Knuesel fogalmazta meg 2013-ban, megnyitva egy új irányvonalat a kór megértésében az addigi elméletek (Hardy és Allsop által felvázolt amiloid-kaszkád elmélete, a Bartus-féle kolinerg hipotézis stb.) mellett.
A gyulladásos reakcióknak egy sajátos formája az agyban szövetkárosodás vagy fertőzés hatására létrejövő neuroinflammáció, amely során az agy speciális védekező sejtje, a mikroglia aktiválódik. Maga a mikrogliasejt az agy fő immunsejtjei, a makrofágok csoportjába tartozó sejttípus, mely az elpusztult sejtek és sejtmaradványok eltakarítását végzi el az agyban. Nyugalmi állapotban a szövetekben cirkulál, majd fenyegetés hatására felszaporodik, aktiválódik és igyekszik a potenciális veszélyt bekebelezéssel – fagocitózissal – elhárítani. Ezzel párhuzamosan gyulladásos molekulák (citokinek) termelődését serkenti, közülük az interleukin-1β és 6, a tumor nekrózis faktor-α és a transzformáló növekedési faktor-β a legjelentősebbek. Érdekes módon a tartós mikroglia-aktiváció során annak fagocitózis tevékenysége csökken, hasonlóan a más kórképekben látottakhoz; például krónikus légúti gyulladásban a fagicitózisra képes sejtek aktivitása csökken, így a betegek fogékonyabbá válnak a fertőzésekre. Mivel az Alzheimeres agyszövetre oly jellemző kóros fehérjéknek, az amiloid plakkoknak és tau kötegeknek a lebontásában ez a funkció alapvető, így feltételezhető, hogy a krónikus gyulladás az idegsejtek károsodása mellett az említett fehérjék lerakódásában is kulcsfontosságú.
Az előbbieket támasztják alá egy másik, a gyulladás szabályozásában részt vevő enzimcsoporttal, a mátrix metalloproteázokkal (MMP) kapcsolatos kutatások is. Ezek az enzimek a károsodott szövet lebontását végzik, s annak helyén az erek és idegszövet újjászületését, újbóli képződését segítik elő. Krónikus mikroglia működés során szabályozásuk zavart szenved, ami az idegszövet fokozott mértékű károsodásával párosul. Sajnálatos módon a kóros amilod és tau környezetében az MMP-k aktivitása tovább fokozódik, így krónikus gyulladás mellett a patológiás fehérjelerakódás többszörösen is az idegsejtek pusztulása irányába hat. Ezt erősíti még, hogy a mikroglia szintén jelentős mértékben aktiválódik amiloid és tau környezetében, mivel azokat patológiás tényezőnek ismeri fel.
A krónikusan aktivált mikrogliasejtek tehát állandóan fenntartják a gyulladásos reakciót (MMP szabályozászavara és fokozott gyulladásos citokintermelés), ugyanakkor eredeti, takarító (fagocitózist folytató) feladatukat már nem képesek ellátni – márpedig ez a jelenség a betegség fontos tényezője lehet. A gliasejtek egy másik csoportja, az alakjuk alapján csillagsejteknek is nevezett asztrociták a központi idegrendszer legnépesebb sejttípusai, melyek az agy térfogatának 25 százalékát teszik ki. Funkcionális szerepüket sokáig alábecsülték, ám ma már tudjuk, hogy számos fontos élettani folyamatban elengedhetetlen a jelenlétük. Részt vesznek az idegsejtkapcsolatok megerősítésében, a vér-agy gát létrehozásában és fenntartásában, valamint az ionegyensúly és az idegsejtek normál környezetének kialakításában, továbbá a glutamát anyagforgalmáért is felelősek.
Érdekes módon a halál utáni szövettani vizsgálatok az asztrociták fokozott jelenlétét mutatták ki Alzheimer-betegségben elhunyt személyeknél. A jelenség, a reaktív asztrogliózis jól ismert, minden idegsejtkárosodással járó gyulladásos folyamat velejárója. Az asztrogliózis a csillagsejtek megnagyobbodásában, számszerű felszaporodásában és a savanyú fibrillaris gliaproteinek (GFAP) fokozott termelődésében nyilvánul meg. Az említett aktiválódott sejtek leginkább az amiloid plakokk területén voltak megfigyelhetők. A reaktív folyamatnak e kóros fehérjék felgyülemlésére gyakorolt közvetlen hatása a mai napig vitatott, de ismert, hogy az aktivált asztrociták által szabályozott α1-antikimotripszin fehérje befolyásolja a béta-amiloid lerakódását és a tau foszforilációját. Számunkra mégis az asztrogliózis mértéke és a szellemi hanyatlás közti korrelációs összefüggés adja a legfontosabb bizonyítékot arra, hogy az asztrogliáknak fontos szerepe van a betegségben, és ennek köze lehet a gyulladásos reakciókhoz.
A legújabb kutatások kimutatták, hogy amennyiben a mikroglia-aktivitás hosszan fennmarad, hatására egy sejtféleség, az A1 típusú asztrocita működése felerősödik. Az ilyen asztrociták a többivel ellentétben nem táplálják vagy védik az idegsejteket, hanem serkentik azok elhalását. Az idegsejtek pusztulása közvetett módon is kialakulhat. Megfigyelték, hogy a reaktív asztrociták nem tudják tökéletesen ellátni a támogató funkciójukat, így az idegsejtek érzékenyebbek lesznek a külső hatásokra, a keletkező szabad oxigéngyökökre és a túlzott glutamát-serkentés sejtkárosító hatására.
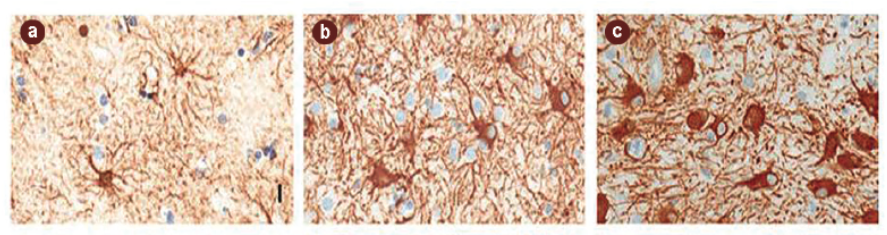
Asztrocita gliák (barna festés) felhalmozódása gyulladást követően az idegsejtek környezetében Alzheimer-kórban szenvedő beteg halál utáni szövettani felvételein.
A fertőzés elmélete
Az a tény, hogy az Alzheimer-kór késői életkorban alakul ki, már leírása óta felvetette azt a lehetőséget, hogy esetleg egy korábban megszerzett, lassan kialakuló fertőzés lehet a hátterében. A szifilisz által okozott demencia és az Alzheimer-betegség klinikai hasonlóságait már maga Alois Alzheimer is felvetette, majd Perusini és Bonfiglio patológiai vizsgálatokkal hasonló szövettani elváltozásokat igazolt. Ezt követően azok a kórokozók kerültek az érdeklődés középpontjába, amelyek neurotróp tulajdonságúak, tehát az idegszövetet támadják elsődlegesen és benne maradnak fenn, továbbá lassú, elhúzódó, akár évtizedeken is átívelő fertőzéseket okoznak. Az elsődleges feltételezéseket megerősítették azok a modern, kórokozókat izoláló vizsgálatok, amelyek bizonyos fertőző mikroorganizmusok fokozott jelenlétét mutatták ki Alzheimer-kór által érintett betegek agyszövetében. A vírusok közül igazolást nyert a herpesz vírusok (például citomegalovírus, humán herpesz vírus 1 és 2), a baktériumok közül a Chlamydia pneumoniae, a Helicobacter pylori, a Lyme-kórért felelős Borelia burgdorferi, a szifiliszt okozó Treponema pallidum és bizonyos szájüregi baktériumok gyakoribb előfordulása. A gombák közül az érdeklődés középpontjában a Candida albicans van.
Az agyszövet megbetegítésének útja feltételezhetően sokrétű. Ezek a kórokozók képesek arra, hogy a vér-agy gáton átjutva elérjék a központi idegrendszert és ott krónikus gyulladásos reakciót kialakítva kedvezzenek az Alzheimer-kór kialakulásának. Ennek alapja, hogy bejutásukra elsődlegesen a mikroglia reagál, amely kulcstényező az Alzheimer-betegségben. A szervezet általában képes ezek elpusztítására, ugyanakkor hosszan elnyúló fertőzőképességük alapja az, hogy olyan stratégiákat fejlesztettek ki, amelyekkel könnyen rejtve maradhatnak vagy átvészelhetik az immunrendszer támadásait. Valamilyen okból csökkent védekező képesség (például idősebb életkor) esetén ennek esélye jócskán megnő.
Egy másik lehetséges mechanizmus, hogy a kórokozók valójában a perifériás területeken hoznak létre a szervezet egészét mozgósító immunreakciót, amelynek következtében a periférián jelenlévő immunsejtek elárasztják a központi idegrendszert is, majd ott a mikrogliákra emlékeztető működést fejtenek ki. Ezt erősítik azok a vizsgálatok, amelyek a demencia gyakoribb előfordulását mutatták ki olyan idős emberek esetében, akik krónikusan visszatérő fertőzésekben szenvedtek.
Ugyanakkor fontos tisztáznunk, hogy jelenlegi tudásunk szerint egy kórokozó sem felelős önmagában az Alzheimer-betegségért, ezek a mechanizmusok feltételezhetően csak részjelenségei a betegség okának. Mindazonáltal a fertőzések szerepe az idegrendszeri kórképek kialakulásában továbbra is fontos kutatási irány.
A fertőzések betegségkeltő szerepére az egyik lehetséges elmélet a látens herpesz fertőzések ismételt aktiválódása. Ezt először egy 1982-es vizsgálatban vetették fel, amelyben azt találták, hogy az Alzheimer-kór első szakaszában érintett agyi szövetek jócskán átfedésben vannak azokkal a területekkel, amelyekben kimutatható a humán herpeszvírus 1 (HS1) jelenléte. A vírust az emberi populáció 80 százaléka hordozza, az elsődleges fertőzés után megbújik az agyidegdúcok területén, ott él túl. Időszakos újraaktiválódása akkor következik be, ha az immunrendszer állapota romlik. Ez jól tetten érhető pszichés és mentális stressz vagy betegség időszakában, amikor a herpeszvírus újra megjelenik, ajakherpeszt okozva. Amennyiben az Alzheimer-betegségre hajlamosító tényezők állnak fenn (például Apo-e4 genetikai defektusa), úgy a herpeszvírusnak szerepe van a már említett amiloid és tau fehérjék kóros kialakulásában azáltal, hogy újbóli fellángolásával a mikroglia krónikus működését okozza. A vírusok szaporodását gátló, antivirális terápia vagy a fertőzés elleni védőoltások fejlesztése ígéretes irány, azonban ezeknek a gyógyszereknek számos mellékhatása van, a herpesz vírus elleni megbízható védőoltások sajnos még csak korlátozottan állnak rendelkezésre.
A baktériumok sokaságából a Spirochéták megkülönböztetett figyelmet élveznek annak köszönhetően, hogy ezek – a véráram mellett – képesek a nyirokutak és idegrostok útján is elérni az agyszövetet. Közülük a legismertebbek a szifilisz és a Lyme-kór már említett kórokozói. Ezek sajátja, hogy akár az orrüregi nyálkahártya közvetítésével, a szaglóidegeken át is bejuthatnak az agyba. Alzheimer-betegek szagló idegsejteiben több vizsgálat is igazolta ezeknek a baktériumoknak a jelenlétét a betegség korai szakaszában. Ez különösen érdekes annak fényében, hogy a szaglászavar a neurodegeneratív betegségekben sokszor megelőzi a szellemi képességek hanyatlásának jelentkezését.
A Spirochéták további jellegzetessége, hogy az akut fertőzés után nagyon gyakran krónikus gyulladás alakul ki, mivel plakk-képző sajátossággal rendelkeznek: képesek olyan burkot felépíteni maguk köré, amely megvédi a kórokozót az immunrendszertől. A krónikus gyulladás a mikroglia működésen keresztül kedvez a kóros fehérjék lerakódásának. Érdekesség, hogy a Spirochétákban eleve található olyan fehérje, amely az amiloid képződését közvetlenül serkenti. Ennek a baktériumcsoportnak amúgy számos faja normálisan is jelen van szervezetünkben, a szájüregi flóra gyakori alkotói.
Szájüregi flóránk elképesztő mértékben változatos, a molekuláris vizsgálatok szerint körülbelül 900 baktériumfaj otthona. Érdekes módon, a fajok típusa és száma jelentős egyéni eltéréseket mutat, akár 200 baktériumfajban is különbözhetünk egymástól. A velünk élő mikrobák – a mikrobiom – fontosságát egyre több betegség kapcsán igazolják, ebben az Alzheimer-betegség sem kivétel. A szájüregi flóra változatossága fontos tény annak fényében, hogy a leggyakoribb szájüregi gyulladások (fogszuvasodás, fogágy gyulladása, fogínygyulladások) rendkívül gyakoriak, a lakosság 60–80 százalékát érintik, amelynek fő okai a megváltozott táplálkozási szokások és a rossz orális higiénia. Ezek a gyulladásos folyamatok – különösen a foggyökérhártya gyulladása (periodontitisz) – jelentősen megváltoztatják a szájüregi flóra összetételét, kedvezve az oxigén hiányában is életképes baktériumfajok elszaporodásának. Közülük a Treponema denticola, a Tannerella forsythia és a Porphyromonas gingivalis fontos fajok az Alzheimer-kór kialakulásában is. Vizsgálatok kimutatták ugyanis, hogy ezek a mikrobák a nyirokutakon és a fogakat beidegző agyidegágakon keresztül képesek arra, hogy bejussanak az agyszövetbe. Követéses vizsgálatok igazolták, hogy azoknál a betegeknél, akik esetében kimutatható volt az ezekkel a baktériumokkal való fertőzés, nagyobb eséllyel alakult ki Alzheimer-betegség. Feltételezhető, hogy a baktériumok sejtfala olyan anyagot (lipopoliszacharidot) tartalmaz, amely hatására gyulladáskeltő citokinek termelődnek, és ez a mikroglia tartós aktivációját idézi elő. A baktériumok képesek túlélni az agyszöveten belül is, ilyen módon krónikus gyulladásos gócként hatnak. A szájüregi gyulladások fontosságát egyre több vizsgálat igazolja. Egy 2010-es, nagy elemszámú (597 fő), 32 éves követéses vizsgálat erős összefüggést igazolt a demencia megjelenése és a fogvesztés, fogínyvérzések, a fog melletti tasakok mélysége és a fog körüli csontos meder elvesztése között. Úgy tűnik, a szájhigiénia egy kitüntetetten fontos, befolyásolható rizikófaktor Alzheimer-betegség esetében.
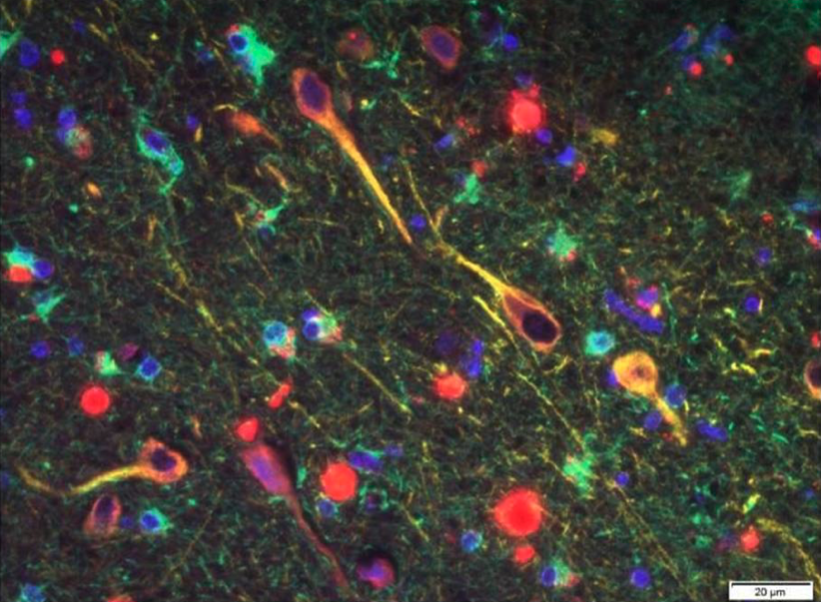
Porpyhriomonas gingivalis baktérium kimutatása szövettani eljárással Alzheimer-kórban elhunyt beteg agyszövetében.